Ácido acético
El ácido acético es un ácido monocarboxílico levemente corrosivo. También conocido como ácido etanoico, ácido metanocarboxílico, acetato de hidrógeno o ácido etílico. Este compuesto orgánico se utiliza en la fabricación de productos químicos, como aditivo alimentario y en la producción de petróleo. La fórmula molecular del ácido acético es C 2 H 4 O 2 o CH 3 COOH, donde –COOH define la presencia de un solo grupo carboxilo.

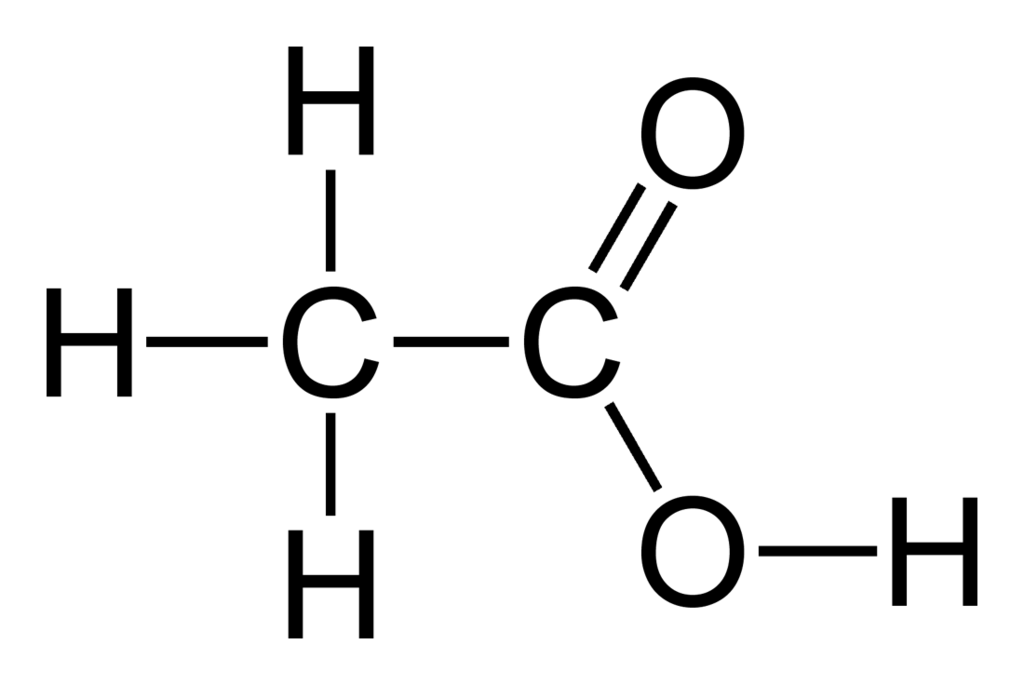
Estructura de ácido acético
La estructura del ácido acético es la de un ácido carboxílico simple y consiste en un grupo metilo unido a un grupo carboxilo como se ve en la imagen de abajo. El ácido acético o ácido etanoico es un disolvente prótico; es capaz de donar protones en forma de hidrones (átomos de hidrógeno cargados positivamente). Esta característica significa que es miembro del grupo ácido de Brønsted, donde los protones se donan a moléculas aceptoras conocidas como bases de Brønsted. El hidrógeno donado se disocia del grupo carboxilo.
El vinagre es una solución de ácido acético y agua en la que aproximadamente el 0,4% de las moléculas de ácido acético ceden sus átomos de H + dando lugar a una solución ácida de aproximadamente 2,4 pH. En comparación con el ácido más fuerte del mundo, el ácido carborano (H (CHB11 Cl 11 )) – con un valor de pH de -18, el ácido acético es ligeramente ácido en comparación.
Debe quedar claro que no es la presencia de un solo átomo de hidrógeno lo que cambia el pH de una solución . Las soluciones neutras (ni ácidas ni alcalinas) contienen un número equilibrado de iones hidronio (H 3 0 +) e iones hidroxilo (OH –). Se forman dos moléculas de agua (H 2 0) cuando un ion hidronio y un ión hidroxilo se unen y las cargas positivas y negativas se cancelan. Cuando se agrega ácido acético al agua, se divide en un ion acetato cargado negativamente (CH 3 COO – ) y H +. Por lo tanto, es posible comprender el nombre alternativo del ácido acético: acetato de hidrógeno. Un pequeño porcentaje de iones de hidrógeno cargados positivamente se unen a las moléculas de agua y las convierten en H 3 0 +. Esto significa que hay más iones hidronio y, por lo tanto, se crea una solución con carga positiva (o ácida).
El pH de una solución depende, por tanto, del equilibrio de hidronio e hidroxilo y no del número de iones hidrógeno, aunque estos afectarán este equilibrio. Además, solo se le da un valor de pH a una solución. Una solución siempre contiene agua; incluso los superácidos modernos como el carborano se disuelven en soluciones acuosas concentradas de otros ácidos. Incluso el ácido acético glacial tiene una pequeña cantidad de agua.
La siguiente imagen muestra la disociación del ácido acético en acetato en agua. A la izquierda hay una sola molécula de ácido acético y una sola molécula de agua. El ácido acético pasa un ion hidrógeno a la molécula de agua para producir un ion hidronio. Decimos que la molécula de agua está protonada o se le ha donado un protón (hidrón).

Como disolvente, el ácido acético líquido disuelve compuestos polares (hidrófilos) como sales y azúcares y compuestos no polares que incluyen grasas y aceites. Esto significa que tiene muchos usos en la producción química industrial, pero también se ha ganado la reputación de ser un suplemento para bajar de peso, ya que afecta el metabolismo de las grasas y el azúcar. Más adelante en este artículo se discutirá más información relacionada con los usos del ácido acético. En forma cristalina, dos moléculas de ácido acético se unen con enlaces de hidrógeno para formar un dímero. Cuando se agrega agua, estos enlaces se rompen y la forma cristalina se disuelve.
Fórmula de ácido acético
La fórmula del ácido acético es simple y es el resultado de un grupo metilo y un grupo carboxilo. Los grupos metilo son uno de los compuestos orgánicos más comunes del planeta, pero rara vez se encuentran como entidades individuales. Están compuestos por tres átomos de hidrógeno y un átomo de carbono (CH 3). Como el carbono tiene cuatro electrones, el electrón libre generalmente se une a otras moléculas mediante un enlace covalente. La molécula de carbono más simple es el metano (CH 4), bien conocido por su contribución al calentamiento global. Con un electrón libre, el metano reacciona con el ozono (O 3) para producir dióxido de carbono y agua en la siguiente reacción: (3) CH 4 + (4) O 3 = (3) CO 2 + (6) H2 O. La imagen muestra una molécula de metano compuesta por un grupo metilo y un átomo de hidrógeno extra.
En el caso del ácido acético, el electrón libre se une a un grupo carboxilo (CO 2 H, -COOH o -C (= O) OH) que es un solo átomo de carbono unido a un grupo hidroxilo (-OH) y de doble enlace. a un átomo de oxígeno. La siguiente imagen muestra un grupo carboxilo donde R representa el resto de la molécula a la que está unido el grupo carboxilo; la letra R a veces se reemplaza por una línea ondulada. En el caso del ácido acético, R representa el grupo metilo. Algunos prefieren describir el grupo carboxilo como una combinación de un grupo carbonilo (C = 0, donde = indica el doble enlace) y un grupo hidroxilo (OH). Los ácidos carboxílicos se encuentran en los aminoácidos y son esenciales para todos los organismos vivos.
Existe una fórmula molecular general para todos los ácidos carboxílicos, a saber, C n H 2n + 1 COOH. Esto significa que cada ácido carboxílico presenta el doble de átomos de hidrógeno que de carbono una vez que se elimina el grupo carboxilo ; una fórmula que encaja perfectamente con la del ácido acético – C2H4O2. Cuando elimina el grupo carboxilo de esta fórmula de ácido acético, queda un átomo de carbono y dos de hidrógeno.
Curiosidades del ácido acético
Más información sobre el ácido acético para aquellos que quieran aprender un poco más.
La masa molar de ácido acético es 60,052 gramos por mol (g / mol). La masa molar es la masa total de un elemento o compuesto (masa atómica) medida en unidades de masa atómica o ‘amu’, dividida por su cantidad en moles (mol). Un solo mol se basa en el número de Avogadro 6.02214076 × 10 23, ya que este número significa que la comparación entre los moles y los Dalton, otra unidad científica de masa atómica, es más simple.
El ácido acético glacial es una solución de ácido acético en una cantidad muy pequeña de agua, menos del 1%. La palabra glacial se refiere a su forma sólida cristalina a temperatura ambiente. Otro nombre para el ácido acético glacial es ácido acético anhidro. Esta forma es un ácido débil pero un veneno corrosivo, que causa ampollas y quemaduras. Como hay muy poca agua para disociar, el ácido acético glacial pasará sus protones al agua en la piel o las membranas mucosas.
Encontrar el agente tampón adecuado para un ácido como el ácido acético requiere conocer el pH, K a o pK a del ácido. El pH, K a y pK a están relacionados entre sí. El ácido acético tiene un K a de 1,8 x 10-5 o un más fácil de calcular pK a valor de 4,756. El pH mide el número de iones de hidrógeno (H + ) en cualquier solución que contenga agua y varía de 0 (ácido) a 14 (básico).
Cuanto menor sea el pH, mayor será la concentración de iones de hidrógeno. El K a y el pK a se relacionan con los ácidos y se relacionan con la constante de disociación del ácido que muestra la probabilidad de que el ácido ceda sus protones. Un alto K a nos dice que un ácido es fuerte y reaccionará a cualquier químico que se le agregue. El pK a es lo opuesto: cuanto menor es el número, más fuerte es el ácido. Esto se debe a que pK a es un logaritmo negativo de K a .
Sin embargo, el ácido acético concentrado puede tener un pH más bajo que un ácido fuerte. Gracias al pK a que es un valor constante, podemos realizar cálculos sin tener que pensar en concentraciones. El pK a del ácido acético es 4.756 y esto nos dice qué tan probable es que ceda sus protones en una solución. Las bases se miden según la probabilidad de que eliminen protones de una solución.
El punto de ebullición del ácido acético está entre 118 y 119 ° C y su punto de fusión se encuentra entre 16 y 17 ° C o justo por debajo de la temperatura ambiente. La densidad del ácido acético es 1.049 g cm −3 en estado líquido y 1.27 g cm −3 en estado sólido.
La forma de ácido acético más comúnmente reconocida es el vinagre que contiene 5-20% de ácido acético. La magnitud de la dilución (y, por tanto, la fuerza del ácido) se denomina fuerza de grano. Puede calcularlo fácilmente multiplicando la concentración por 10. El vinagre que contiene ácido acético al 5% tendrá una fuerza de grano de 50.
Usos del ácido acético
Los usos del ácido acético son muchos y variados. Este ácido se utiliza en la fabricación de productos, en el procesamiento de alimentos, en la industria de la limpieza, en la medicina y como suplemento para la salud. El ácido acético también es un esencial bioquímico en forma de grupo acetilo, donde es fundamental para la construcción de aminoácidos y, por lo tanto, es imposible existir sin él. Echemos un vistazo a algunos de estos usos del ácido acético con más detalle.
Ácido acético en la industria
El ácido acético es un reactivo químico importante que se utiliza para producir acetato, adhesivos, colas y telas sintéticas. El ácido acético también se utiliza en galvanoplastia, donde se deposita un recubrimiento metálico sobre un objeto colocándolo en una solución que contiene una sal metálica específica. La solución debe ser conductora y los ácidos que donan iones de hidrógeno crean las condiciones ideales. Además, la galvanoplastia solo puede ocurrir dentro de una solución y las sales metálicas solo se disuelven en soluciones con un valor de pH bajo (ácido).
El ácido acético es una materia prima utilizada para la producción de acetato de celulosa, anhídrido acético (plásticos) y ácido cloroacético que se utiliza en la producción de tintes y pesticidas, así como de ciertos medicamentos.
Ácido acético en el procesamiento de alimentos
Ácido acético utilizado en el procesamiento de alimentos para regular los niveles de acidez o alcalinidad de los alimentos. El Código de Regulaciones Federales (CFR) clasifica el ácido acético como un aditivo alimentario de uso general que es seguro cuando se usa de acuerdo con las buenas prácticas de fabricación. En Europa, las regulaciones del número E se aplican a todos los aditivos alimentarios. El ácido acético tiene el código E260 y se considera un ingrediente seguro que controla la colonización bacteriana y puede usarse sin limitación. Este no es un hallazgo nuevo. Se dice que los antiguos babilonios usaban vinagre como conservante de alimentos.
El vinagre se usa para producir aderezos para ensaladas, condimentos que incluyen mostaza, ketchup y mayonesa, y en salsas y encurtidos.
Ácido acético para limpieza
El ácido acético se ha utilizado como producto de limpieza y desodorante durante siglos, si no milenios; Se colocaban esponjas de vinagre en costosos anillos de filigrana que usaban los ricos cada vez que pasaban por las sucias y malolientes calles del siglo XVIII. Las propiedades desodorantes del vinagre también se han aprovechado durante generaciones. Los marineros usaban vinagre para fregar las cubiertas de los barcos en los que trabajaban y vivían. Es posible que en ese momento no se entendieran los principios del control microbiano, pero las características de olor fresco, limpio y preventivo de enfermedades de esta solución orgánica eran definitivamente bien conocidas.
Agregar un producto alcalino al ácido provoca una reacción burbujeante y burbujeante. Algunos limpiadores tradicionales creen que este efecto produce una limpieza más profunda en superficies estables. Por ejemplo, fregar el patio trasero con soda cáustica alcalina (hidróxido de sodio) y luego usar una mezcla de vinagre encima desencadenará una reacción que ciertamente parece tener una acción de limpieza profunda; sin embargo, esto hace muy poco para aumentar el efecto higiénico, sino que amortigua o actúa contra el poder limpiador alcalino de la sosa cáustica con las propiedades ácidas del vinagre.
Hoy en día, muchos fanáticos del vinagre blanco anuncian los beneficios ecológicos de usar ácido acético diluido para limpiar baños, lavar ropa, eliminar olores y hacer que las superficies de preparación de alimentos estén limpias y seguras. El ácido acético también elimina los depósitos de óxido y cal.
Ácido acético en medicina
El ácido acético o el vinagre probablemente se haya utilizado en medicina desde antes de los primeros registros. Si hubiera sufrido una herida abierta en la isla de Cos en el siglo IV antes de Cristo, es posible que Hipócrates le hubiera recetado un lavado diario de vinagre. También si le dolía la garganta, es posible que también le haya pedido que mezcle miel y vinagre para hacer Oxymel, un antiguo medicamento griego para la tos; Si sirvió en Europa durante la Primera Guerra Mundial, es posible que solo haya tenido acceso al vinagre para mantenerse limpio y libre de infecciones.
Hoy en día, las soluciones de ácido acético se utilizan en procesos de análisis de sangre de laboratorio como lavado de portaobjetos. Eliminan las biopelículas bacterianas en las heridas y el sistema digestivo y, a menudo, se han utilizado para las infecciones del oído externo, por lo que evitan el uso de antibióticos. La ingestión de vinagre aumenta los niveles de acetato en el colon y promueve la absorción de calcio con una presión arterial más baja y una mayor densidad ósea como resultado. Los estudios están investigando el uso de acetato como medicamento antitumoral.
Ácido acético como suplemento para la salud
El ácido acético es un suplemento de salud popular y se consume en forma de vinagre, más comúnmente vinagre de sidra de manzana. Cuando se une a la coenzima A, el grupo acetilo del ácido acético es fundamental para el metabolismo de los carbohidratos y las grasas .
Se han realizado muchos estudios sobre el vínculo entre el consumo de vinagre y niveles más bajos de glucosa en sangre. Cuando se consumen alimentos de alto índice glucémico después de la ingestión de dos o tres cucharadas de vinagre de sidra de manzana, se ha demostrado que sus valores glucémicos son hasta un 35% más bajos. Para los diabéticos, esto podría significar picos más bajos de glucosa en sangre posprandial y un mejor control glucémico y para los no diabéticos un menor riesgo de desarrollar resistencia a la insulina . La sustitución del pepino normal por un pepino encurtido mostró una reducción del 30% en el valor del índice glucémico total de la comida.
La siguiente imagen muestra el efecto de los alimentos con índice glucémico (IG) bajo y alto sobre los niveles de glucosa en sangre. Los alimentos con IG alto provocan un pico rápido en los niveles de glucosa en sangre que aumentan la producción de insulina, lo que permite a las células metabolizar la glucosa. Esto significa que el nivel de glucosa en sangre desciende rápidamente y provoca hambre.
Los alimentos con IG bajo provocan un aumento más suave del azúcar en sangre y no obligan al páncreas a producir cantidades tan grandes de insulina. El resultado es una curva suave que permanece estable y no desciende, aumentando los niveles de saciedad después de una comida. Cuando un alimento con IG alto y un alimento con IG bajo se comen al mismo tiempo, se anulan parcialmente entre sí, creando un efecto de meseta. Se sabe que el vinagre tiene el mismo efecto que un alimento con IG muy bajo.
Como ya se mencionó, el ácido acético también se considera un suplemento para la pérdida de peso debido a su capacidad para nivelar el pico de glucosa después de las comidas y, por lo tanto, ayuda a aumentar la saciedad . También se sugiere que la presencia de ácido acético en la dieta ralentiza el vaciado gástrico, lo que también ayuda a controlar algunas formas de comer en exceso. Además, el vinagre parece desalentar la formación de grasa en dosis de tan solo quince mililitros por día.
Descubre en nuestro blog todo acerca de cómo se crean las vacunas aquí.
« Volver al diccionario



